Atome sind Bausteine für jede feste, flüssige und gasförmige Materie. Die Atome eines Elements haben eine spezifische Anzahl an Neutronen und Protonen im Atomkern sowie eine spezifische Anzahl an Elektronen, die sich um den Atomkern bewegen. Anhand der Protonen- und Elektronenanzahl werden die einzelnen Elemente im Periodensystem in Haupt- und Nebengruppen sowie Perioden eingeordnet. Aus dem Periodensystem lassen sich weitere Information wie die Oxidationszahl und die Elektronegativität ableiten. Der individuelle Atomaufbau ist außerdem Basis für das Verhalten in chemischen Reaktion und Bindungen.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Der chemische Grundbaustein ist das Atom. Das Wort kommt aus dem Griechischen und heißt eigentlich das Unteilbare. Erst später wurde entdeckt, dass es diesem Namen gar nicht gerecht wird, denn ein Atom wird noch aus viel kleineren sog. Elementarteilchen aufgebaut:
Protonen und Neutronen befinden sich im Atomkern und werden auch als Nucleone zusammen gefasst. Die Neutronen übernehmen dabei in etwa die Aufgabe eines Klebstoffes. Sie stabilisieren den Kern, andernfalls würden sich die gleich geladenen Protonen gegenseitig abstoßen.
Die Elektronen hingegen bewegen sich in einer Elektronenhülle oder Elektronenwolke um den Kern herum. Sie tragen so gut wie nichts zur Masse eines Atoms bei, die Hülle macht aber den Großteil des Volumens aus.
Die Ausdehnung der Elektronenhülle konnte mit dem Rutherford’schen Streuversuch dargestellt werden. Bei diesem Experiment wurde eine Goldfolie mit α-Teilchen (Heliumkerne) beschossen. Ein Fluoreszenzschirm, der um die Folie herum aufgebaut war, diente dem Auffangen und Sichtbarmachen der α-Teilchen. Trafen sie auf der Folie einen Kern der Goldatome, so wurden sie von ihrer Bahn abgelenkt. Schossen sie lediglich durch die Atomhülle, konnten sie ihre Bahn linear fortsetzen und trafen direkt hinter der Folie auf dem Schirm auf. Im Versuch wurden dort die meisten Einschläge gefunden, nur einige trafen davon abweichend auf.
Ein Atom ist nach außen hin ungeladen. Verliert oder erhält es ein Elektron dazu, würde die Nettoladung nach außen hin nicht mehr ausgeglichen sein: ein Ion.
| Proton | Neutron | Elektron | |
|---|---|---|---|
| Masse mo | 1,0073 u | 1,0087 u | 5,485 x 10-4 |
| Ladung q | +1,602 x 10-19 | 0 | -1,602 x 10-19 |

Schematischer Aufbau eines Atoms
Bild: „Bohr Atom Structure“ von CNX OpenStax, Lizenz: CC BY 4.0Der Atomkern (Nucleus) enthält positiv geladene Protonen und Neutronen, welche keine Ladung besitzen. Das Besondere ist, dass der Nucleus zwar wesentlich kleiner im Vergleich zu der Hülle ist, jedoch gleichzeitig 99 % der Masse des gesamten Atoms ausmacht.
Nuklide mit der gleichen Protonen-, aber einer anderen Neutronenzahl gehören zwar zum gleichen Element, werden jedoch als Nukleone bezeichnet.
Ein Nuklid wird durch folgende Angaben charakterisiert:
Die Elektronenzahl lässt sich von der Protonenzahl ableiten. Die Neutronenzahl berechnet sich aus der Massenzahl min
Bei den Isotopen handelt es sich um Atome des gleichen Elements, welche sich in der Neutronenzahl unterscheiden. Das bedeutet, die Anzahl der Protonen der Atome ist gleich und somit auch die Ordnungszahl, nur die Anzahl der Neutronen variiert.
Berechnung der Massenzahl: Massenzahl = Anzahl der Protonen + Anzahl der Neutronen
Beispiel: Kohlenstoff, Ordnungszahl 6 (d. h. 6 Protonen und 6 Neutronen), Massenzahl 12,011
Die meisten Elemente in der Natur kommen als Mischelemente vor. Das heißt, es gibt verschieden viele Isotope von ihnen, die mit größerer oder geringerer Häufigkeit auftreten. Die Atommasse wird daher auch als relative Atommasse angegeben, die praktisch als Durchschnittswert angesehen werden kann. Ein Beispiel ist Wasserstoff mit seinen stabilen Isotopen Protium und Deuterium enthält.
Neben den natürlichen gibt es auch künstliche Isotope. Beide Formen können wiederum stabil oder radioaktiv sein. Radioaktivität beschreibt einen instabilen Zustand, in dem der Kern spontan ohne weitere Energieeinwirkung zerfällt. Grund dafür kann ein Neutronenmangel bzw. -überschuss sein.
Für rund 20 der Reinelemente (u. a. Natrium, Phosphor, Fluor) existiert nur ein stabiles Isotop, daher werden sie als anisotop bezeichnet.
Neben den Isotopen gibt es auch:
In der Hülle des Atoms bewegen sich die Elektronen auf ellipsenähnlichen Bahnen um den Nucleus herum. Nach dem Bohrschen Atommodell wird die Elektronenhülle in verschiedene Schalen unterteilt. Elektronen bewegen sich auf diesen und unterscheiden sich von Schale zu Schale in ihrem Abstand zum Kern sowie im Energieniveau. Die Elektronen füllen die Schalen von innen nach außen auf. Diese sind chronologisch beziffert, begonnen mit dem Buchstaben K. Das heißt, die erste bzw. die innerste Schale heißt „K“, die zweite „L“, die Dritte „M“ u.s.w.
Die maximale Anzahl an Elektronen, welche auf eine Schale passen, lassen sich durch folgende Gleichung berechnen: 2 n² (n ist die Nummer der Schale).
Nach dem Bohrschen Atommodell wird die Elektronenhülle in verschiedene Schalen unterteilt. Elektronen bewegen sich auf diesen und unterscheiden sich von Schale zu Schale in ihrem Abstand zum Kern sowie im Energieniveau.
In einem erweiterten Modell wird angenommen, dass der Aufenthaltsort eines Elektrons innerhalb der Hülle nicht genau detektieren werden kann. Die Aufenthaltsräume, in denen sich ein Elektron aber mit großer Wahrscheinlichkeit aufhält, werden Orbitale genannt und sind nicht zwangsläufig symmetrisch.
Jedes Elektron in der Elektronenhülle kann einem Elektronenzustand zugeordnet werden, die von vier Quantenzahlen charakterisiert werden. Es gibt dabei nie zwei völlig identische Elektronenzustände innerhalb eines Atoms! Diese Gesetzmäßigkeit nennt sich Pauli-Prinzip.
Die Hauptquantenzahl n ist eine ganze Zahl von 1 bis 7 und beschreibt den Abstand des Elektrons zum Kern. Sie ist also der Schale gleichzusetzen. Nach der alten Bezeichnung (im Periodensystem noch vorhanden), werden diese nach Buchstaben (K-, L-, M-Schale etc.) benannt.
Die Nebenquantenzahl l gibt Auskunft über das Orbital, in dem sich das Elektron aufhält. Es ist ein Unterniveau innerhalb einer Schale, wobei die
Über die Magnetquantenzahl m wird das Unterniveau noch weiter aufgespalten.
Die vierte Spinquantenzahl s nimmt entweder den Wert +½ oder -½ ein und beschreibt die Drehrichtung eines Elektrons um seine eigene Achse.
Die Elektronenkonfiguration eines Elements gibt die Quantenzahl aller Elektronen eines Atoms wieder.
Atome sind ladungsneutrale Teilchen, d. h. sie besitzen gleich viele Elektronen und Protonen. Gibt ein Atom im Zuge einer Reaktion Elektronen ab oder nimmt welche auf, heißt es geladenes Atom, einem sogenannten Ion. Positive Ionen, bei denen weniger Elektronen als Protonen vorhanden sind, werden als Kationen bezeichnet. Negative Ionen, also Ionen mit einem Elektronenüberschuss, sind auch unter dem Namen Anion bekannt.
Ionen der Hauptgruppenelemente haben wie die Edelgasatome entsprechend der Oktettregel eine voll besetzte Außenschale.

Periodensystem der Elemente
Bild: „Periodic table of elements with german names“ von Oldracoon. Lizenz: CC0 1.0Das PSE ist auf Grundlage des Atomaufbaus entwickelt und strukturiert. Es spiegelt den Zusammenhang zwischen Aufbau und Eigenschaften der Elemente wider und einige Informationen, wie z. B. die Elektronegativität, sind direkt angegeben.
Die Elemente sind nach steigender Kernladungszahl (Ordnungszahl) angeordnet, welche gleichzeitig die Anzahl der Protonen angibt.
Dabei sind sie nicht wahllos aneinandergereiht, sondern sie sind in Gruppen gegliedert. Elemente der gleichen Gruppe besitzen die Anzahl an Valenzelektronen (Außenelektronen, die an Atombindungen beteiligt sein können). Bei den Gruppen werden Haupt- und Nebengruppen unterschieden. Bei den Hauptgruppenelementen spielen im Grund nur die s- und die p-Orbitale eine wichtige Rolle, da die d- und die f-Orbitale voll oder gar nicht besetzt sind. Bei den Nebengruppenelementen spielen die d- und die f-Orbitale sehr wohl eine Rolle, da deren teilweise Besetzung die Eigenschaften der Nebengruppenelemente maßgeblich beeinflusst (Elektronenkonfiguration).
Weiterhin lässt sich das PSE waagerecht in die Perioden gliedern. Die Nummer der Periode entspricht der Anzahl der besetzten Schalen nach dem Bohren Atommodell.
Merke: Der Platz eines jeden Elements ist durch die Hauptgruppe und die Periode eindeutig festgelegt.
Metalle sind im PSE links unten zu finden, Nichtmetalle rechts oben.
1869 entwickelte Mendelejew das Gesetz der Periodizität auf Grundlage der regelmäßigen Wiederholung ähnlicher Elementmerkmale. Die von ihm beschriebene Periodizität beruht auf dem inneren Aufbau der Atome und deren Hülle im Besonderen.
Die Gesetzmäßigkeiten spiegeln sich in den Perioden und in den Hauptgruppen wider:
Bei den Nebengruppenelementen handelt es sich um Metalle, auch Übergangsmetalle genannt. Die biochemisch essenziellen Nebengruppenelemente, z. B. Zink Zink Spurenelemente, Eisen Eisen Spurenelemente, Mangan, Kupfer Kupfer Spurenelemente u. v. m. werden auch Spurenelemente Spurenelemente Spurenelemente genannt und sollten regelmäßig in geringen Mengen vom menschlichen Organismus aufgenommen werden. Diese sind wichtig für die Funktion der Metalloenzyme.
Für die Atome gibt es neben den bildlichen Veranschaulichungen noch weitere Darstellungsmöglichkeiten, wie z. B. das Energieniveauschema und die Elektronenkonfiguration.
Bei der Elektronenkonfiguration handelt es sich um die Verteilung der Elektronen auf den Atomorbitalen. Für jedes Atom ist sie spezifisch.
Merke: Ein Orbital ist jener Bereich innerhalb des Atoms, in welchem sich die Elektronen mit hoher Wahrscheinlichkeit befinden. Jedes Orbital enthält maximal zwei Elektronen.
Die Elektronenkonfiguration wird aufgestellt, indem jedes einzelne Orbital aufgeführt wird. Dafür sind zunächst einige Informationen von wichtiger Bedeutung:
Um eine korrekte Elektronenkonfiguration aufstellen zu können, gibt es einige Besetzungsregeln zu beachten:
Energieniveaus/Orbitale sind stabil, wenn sie voll, leer oder halbvoll sind.
Die Darstellung eines Atoms als Elektronenkonfiguration ist auch insofern nützlich, als dass daraus seine Oxidationszahl bzw. -zahlen abgelesen werden kann.
Die Oxidationszahl gibt Auskunft darüber, wie viele Elektronen ein Atom aufgenommen oder abgegeben haben im Vergleich zu seinem elementaren Zustand.
Die Oxidationszahl gibt die Ionenladung (Wertigkeit) an.
Das Ziel eines jeden Atoms ist die Edelgaskonfiguration und um diese zu erreichen, geben die Atome Elektronen ab bzw. nehmen welche auf.
Merke: Die Edelgaskonfiguration ist eine energetisch stabile Anordnung der Elektronen, bei der die Außenschale mit Elektronen voll besetzt ist (Oktettregel). Diesen Zustand streben die Atome sämtlicher Elemente an und er wurde von den Elementen der 8. Hauptgruppe (Edelgase) erreicht, weshalb diese sehr reaktionsträge sind.
Um die Oxidationszahl eines Atoms innerhalb eines Stoffes bestimmen zu können, sind einige Grundsätze zu beachten:
Festgelegte Oxidationszahlen
0. Reine Elemente: ±0
In Verbindungen gilt:
Hinweis: Kommen mehrere Atome aus dieser Liste vor, werden die Oxidationszahlen entsprechend dieser Hierarchie angegeben.
Beispiel: H2O2 → H: +1; O: -1 (Die Oxidationszahl des Wasserstoffes steht in der Hierarchie über der des Sauerstoffes und deswegen erhält Wasserstoff seine in der Liste festgelegte Oxidationszahl.)
Allgemeine Festlegungen:
Grundsätzlich können innermolekulare und zwischenmolekulare Bindungen unterschieden werden. Zu der ersten Gruppe zählen die Ionenbindung, die Atombindung und die Metallbindung. Zu der zweiten genannten Gruppe gehören die Van-der-Waals-Bindung sowie die Wasserstoffbrücken. Diese haben einen wichtigen Einfluss auf die Stoffeigenschaften, wie z. B. die Löslichkeit.
Ionenbindung:
Die Ionenbundung ist eine Art der chemischen Bindung, die auf starken Anziehungskräften zwischen entgegengesetzt geladenen Ionen (Coulomb-Kraft, elektrostatische Kraft) beruht. Durch die Ionenbindung entsteht eine sehr regelmäßige Anordnung von Ionen, welche auch Ionengitter genannt wird. Ist ein Feststoff aus Ionen aufgebaut, so handelt es sich um ein Salz.
Merkmale:
Stoffeigenschaften:
Berechnung:
ΔENW > 1,7
(Elektronegativitätswert (ENW) ist dem PSE zu entnehmen)
Atombindung (kovalente Bindung):
Die Atombindung ist eine Art der chemischen Bindung, welche auf der Ausbildung gemeinsamer Elektronenpaare beruht. Die Atome haben feste Partner, weshalb es eine gerichtete Bindung ist.
Aus dieser Bindungsart lässt sich die Stoffklasse der Molekülsubstanzen ableiten.
Stoffeigenschaften: relativ niedrige Schmelz- und Siedetemperatur
Berechnung: Lage der gemeinsamen Elektronenpaare
Metallbindung:
Die Metallbindung ist eine Art der chemischen Bindung, die auf den Anziehungskräften zwischen positiv geladenen Metall-Ionen und negativ geladenen, frei beweglichen Elektronen beruht.
Aus dieser Bindungsart lässt sich die Stoffklasse der Metalle ableiten.
Merkmale:
Stoffeigenschaften:
Berechnung: nicht berechenbar, tritt bei Metallen und Legierungen auf
Van-der-Waals-Bindung:
Bei den Van-der-Waals-Kräften handelt es sich um schwache Anziehungskräfte bzw. nicht-kovalente Wechselwirkungen zwischen Molekülen, Atomen oder Ionen. Sie ist abhängig von der Teilchengröße und der Berührungsfläche.
Wasserstoffbrücken
Treten zwei Moleküle über ein Wasserstoffatom in Wechselwirkung, so entstehen sogenannte Wasserstoffbrücken. Dabei herrschen starke Anziehungskräfte zwischen dem positiven Wasserstoffatom und einem freien Elektronenpaar des Stickstoff-, Sauerstoff- oder Fluoratoms. Wasserstoffbrücken werden nur mit den elektronegativsten Elementen (N, O, F) gebildet.
Hierbei gibt es einen Donator und einen Akzeptor.
Bei dem Donator ist das Wasserstoffatom an einen stark elektronegativen Partner gebunden, wodurch das Wasserstoffatom zum positiven Pol (positive Partialladung) und der Bindungspartner zum negativen Pol wird. Die Akzeptoren sind in der Regel die kovalent gebundenen Stickstoff-, Sauerstoff- oder Fluoratome, welche eine negative Partialladung besitzen.
Relevanz der Wasserstoffbrücken in der Biochemie:
Ein Stoff kann den Aggregatzustand fest, flüssig oder gasförmig haben.
Dabei handelt es sich um die Änderung des Aggregatzustandes. Während eines Phasenübergangs bestehen gleichzeitig zwei Phasen nebeneinander, z. B. Eis-Wasser-Gemisch, Wasser-Wasserdampf. Während der Änderung des Aggregatzustandes wird immer Energie verbraucht. Wenn bei einem Phasenübergang in eine Richtung Energie zugeführt werden muss, so wird diese während des Phasenübergangs in die andere Richtung wieder frei.
Vorgänge:
Chemische Stoffe reagieren, in dem Bindungen aufgebaut oder gelöst werden. Pendeln sich Hin- und Rückreaktion nach einer bestimmten Zeit ein, so ergibt sich ein Gleichgewicht aus Produkten und Edukten.
Wichtige Reaktionstypen in der Anorganik sind die Redox- und die Säure-Basen-Reaktionen.
Merke: Nach Brönstedt hat eine Säure die Eigenschaft, Protonen abzugeben, d.h als Protonendonator zu wirken.
Eine Base ist durch die Eigenschaft charakterisiert, Protonen aufnehmen zu können, d. h. als Protonenakzeptor zu wirken.
Reagieren eine Säure und eine Base miteinander, so sind es Säure-Basen-Paare. Die Oxidationszahlen verändern sich nicht, anders als bei der Redoxreaktion.

Wenn Chlorwasserstoffgas sich in Wasser auflöst, (a) reagiert es als Säure und überträgt Protonen ins Wasser und bringt (b) Hydronium-Ionen ein (und löst Chlorid-Ionen an).
Bild: „Figure 1“ von Phil Schatz. Lizenz: CC BY 4.0Beispiel:
Eine Sonderform der Säure-Basen-Reaktion ist die Neutralisation. Die Neutralisation ist eine chemische Reaktion, bei der sich Wasserstoff-Ionen und Hydroxid-Ionen zu Wasser verbinden.
Wortgleichung: Hydroxid + Säure → Salz + Wasser
Merke: Eine äquimolare Mengen Säure und Base sollten in eine Reaktion gebracht werden, da eine starke Säure mit einem schwachen Partner so reagiert, dass keine neutrale Lösung (pH-Wert 7) entsteht.
Die Redoxreaktion ist eine Reaktion mit Elektronenübergang, bei der die Oxidation und die Reduktion als Teilreaktionen miteinander gekoppelt ablaufen. Bei der Oxidation kommt es zur Elektronenabgabe und bei der Reduktion erfolgt eine Elektronenaufnahme. Damit verbunden ist eine Änderung der Oxidationszahl.
Voraussetzung für eine Redoxreaktion ist das Vorhandensein zweier korrespondierender Elektronenpaare.
Beispiel:

Beispiel einer Redoxreaktion
Bild: „Redowreaktion von CuO mit H2 zu Cu und H2O“ von Sundance Raphael. Lizenz: CC0 1.0Wie am Beispiel zu sehen ist, wird das CuO reduziert und als Oxidationsmittel bezeichnet. Weiterhin ist zu erkennen, dass die Oxidationszahl des Kupfers sich verändert, während die des Sauerstoffs gleich bleibt. Das bedeutet, dass das Kupferatom der Teil der Kupferoxid-Verbindung ist, welcher Elektronen aufnimmt und somit am Elektronenübergang beteiligt ist.
Das H2 wird oxidiert, d. h. es werden Elektronen abgegeben und es fungiert daher als Reduktionsmittel.
Zusammenfassung:
Sowohl die Säure-Basen-Reaktion als auch die Redoxreaktion zählen als Reaktionstyp zu den Donator-Akzeptor-Reaktionen. Der Unterschied besteht darin, dass bei den Säure-Basen-Reaktionen es Protonen sind, die übertragen werden und bei den Redoxreaktionen sind die übertragenen Teilchen die Elektronen.
Die Grundvoraussetzung für sämtliche chemische Berechnungen ist die Kenntnis der wesentlichen Größe, Maße und Grundeinheiten, die sogenannten Système International d’unités (SI)-Einheiten.
Das MWG liefert die mathematische Grundlage zur Berechnung des Verhältnisses zwischen Produkten und Edukten im eingestellten Gleichgewicht auf Grundlage der dort herrschenden Stoffkonzentration. Das Verhältnis K ist für eine bestimmte Reaktion mit den gleichen Bedingungen konstant.
Voraussetzungen:
K = Gleichgewichts-/Massenwirkungskonstante
Stöchiometrische Zahlen der Reaktionszahlen müssen als Exponenten im MWG berücksichtigt werden.
Bei der Kalorimetrie geht es um das Messen der bei chemischen Reaktionen freigesetzten oder aufgenommenen Wärmemengen.
Voraussetzungen:
Gleichung für kalorimetrische Berechnungen:
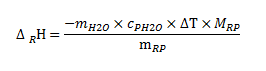
(cp H2O = 4,19 kJ × kg-1 × K-1)
(RP: Reaktionsprodukt)
Dieser Satz besagt, dass die molare Reaktionsenthalpie nur vom Anfangs- und vom Endzustand abhängt und dabei unabhängig vom Reaktionsweg ist.
Ist es nicht möglich, Reaktionsenthalpien direkt zu messen, so können diese indirekt durch den Satz von Hess ermittelt werden, indem die Enthalpien der chemischen Reaktionen aus den aufgelisteten Bildungs- und Verbrennungsenthalpien berechnet werden.
Merke: Die Molare Reaktionsenthalpie ist die umgesetzte Energie einer chemischen Reaktion, bezogen auf die Stoffmenge. (Einheit: kJ/mol)
Berechnung:
ΔRH1 = ΔRH2 + ΔRH3
Der pH-Wert ist der negative dekadische Logarithmus der Hydronium-Konzentration (bei 22 °C) und ist damit ein Maß dafür, wie sauer oder basisch eine Lösung ist.
Diese Rechnung ist besonders relevant für die Säure-Basen-Reaktionen.
Berechnung: pH = – lg{cO}
Beispiel:
→ 0,7 < 7, d. h. es handelt sich um eine stark saure Lösung