T-Zellen, auch T-Lymphozyten genannt, sind wichtige Bestandteile des adaptiven Immunsystems. Ihre Bildung beginnt mit den hämatopoetischen Stammzellen im Knochenmark Knochenmark Knochenmark: Zusammensetzung und Hämatopoese, aus denen T-Zell-Vorläuferzellen entstehen. Diese Zellen wandern zur weiteren Reifung in den Thymus. Eine funktionelle, reife T-Zelle entwickelt sich in mehreren Schritten. Ein T-Zell-Rezeptor T-Zell-Rezeptor Zellen des erworbenen Immunsystems (TCR)-Komplex wird zusammengesetzt, T-Zellen mit guter, regelrechter Affinität zu MHC-Komplexen zu Selbstantigenen werden selektiert (positive Selektion) und entweder CD4 oder CD8 exprimiert. Im Selektionsprozess gehen Zellen, die für Autoimmunität Autoimmunität Autoimmunität prädisponiert sind, in Apoptose (negative Selektion). Wenn sie den Thymus verlassen, wandern die naiven reifen T-Zellen zur Aktivierung zu den sekundären lymphatischen Organen. Zur Aktivierung der T-Zellen sind zwei Signale, eine antigenspezifische Bindung des TCR und Costimulation, notwendig. Bei CD8+ T-Zellen ist eine zusätzliche Zytokinstimulation erforderlich. Abhängig von den Zytokinen, denen sie während der Antigenstimulation ausgesetzt sind, entwickelt sich die undifferenzierte reife T-Zelle (Th0) zu Zellen mit unterschiedlichen Funktionen: CD4+ Zellen werden zu T-Helfer-Zellen (Th) und CD8+ Zellen zu zytotoxischen Zellen(Tc). Th-Zellen können in weitere Subtypen unterteilt werden. Die Wichtigsten sind Th1, Th2, Th17, follikuläre Th-Zellen und regulatorische T-Zellen. Besondere T-Zellen umfassen natürliche Killer-T-Zellen und T-Gedächtnis-Zellen. Reife differenzierte T-Zellen gewährleisten eine effektive Überwachung und sofortige Reaktion auf Krankheitserreger, Tumorzellen und fremdes Gewebe und bilden ein immunologisches Gedächtnis aus.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Der Prozess beginnt in der äußeren Rinde des Thymus und im Verlauf der Reifung wandern die Zellen in die tiefere Rinde ein.

Der T-Zell-Rezeptor bedeckt die zytoplasmatische Membran und projiziert variable Bindungsregionen in den extrazellulären Raum, um von MHC-Klasse-I- oder MHC-Klasse-II-Proteinen präsentierte Antigene zu binden
Bild von Lecturio.
Vergleich des B-Zell-Rezeptors (BCR) und des T-Zell-Rezeptors (TCR)
Bild von Lecturio.Um ihre Funktionalität zu erlangen, durchläuft die T-Zelle von der Freisetzung als Vorläuferzelle aus dem Knochenmark Knochenmark Knochenmark: Zusammensetzung und Hämatopoese bis hin zur Reifung im Thymus verschiedene Stadien.
| Reifephase | T-Zell-Rezeptor T-Zell-Rezeptor Zellen des erworbenen Immunsystems | Assoziierte Entwicklungsschritte |
|---|---|---|
| Vorläuferzelle | Keiner |
|
| DN-Zellen | Umlagerung der β-Kette (Prä-TCR): Ausbleibende Umlagerung führt zur Apoptose |
|
| DP-Zellen | Umlagerung von ɑ-Kette → Verbindung von ɑ- und β-Ketten → vollständiger ɑ-β-TCR-CD3-Rezeptorkomplex (Expression auf Oberfläche) |
|
| Reife naive T-Zellen |
|

Differenzierungsstadien der T-Zelle:
Aus dem Knochenmark gelangen Vorläuferzellen zur Reifung in den Thymus. Die DN-Zellen (fehlende Expression von CD4/CD8 oder auch CD4–/CD8–) haben noch keinen TCR entwickelt. Die DN-Zellen durchlaufen eine Umlagerung des TCR-Gens und werden erst zu Pro-T-Zellen und dann zu Prä-T-Zellen. Im Laufe des Prozesses werden CD4 und CD8 exprimiert und der TCR wird durch Genumlagerungen zusammengesetzt (Entstehung DP-Zellen). Der Thymus präsentiert den sich entwickelnden T-Zellen anschließend MHC-Moleküle. Einige Zellen durchlaufen eine positive Selektion (Interaktion zwischen MHC und TCR findet statt) und es entstehen funktionelle Zellen. Andere Zellen durchlaufen eine negative Selektion (zu starke Interaktion zwischen MHC und TCR), die zur Apoptose führt. So wird die Freisetzung dysfunktionaler T-Zellen, die Autoimmunität aktivieren können, verhindert. T-Zellen, die nicht interagieren, gehen in Apoptose über. Reife T-Zellen exprimieren entweder CD4 (T-Helfer-Zellen) oder CD8 (zytotoxische T-Zellen), nicht beide.
„8er-Regel“ :

Aufbau und funktionelle Regionen eines Lymphknotens, bestehend aus einer kollagenreichen Bindegewebskapsel und einem darunter liegenden subkapsulären Sinus.
Die zellulären Bestandteile können auf den Kortex (1), bestehend aus B-Zellen, follikulären T-Helfer-Zellen und follikulären dendritischen Zellen, die in primären Follikeln angeordnet sind, in denen B-Zellen Antigene erkennen, die ein follikuläres Netzwerk dendritischer Stromazellen präsentiert werden, und den Paracortex (2) mit T-Zellen, dendritische Zellen und fibroblastische Retikulumzellen, die das Netzwerk der Stromazellen und retikuläre Fasern bilden, aufgeteilt werden.
Das innere Mark besteht aus lymphatischem Gewebe (Marksträngen), das von Lymphe führendem Marksinus durchzogen wird.
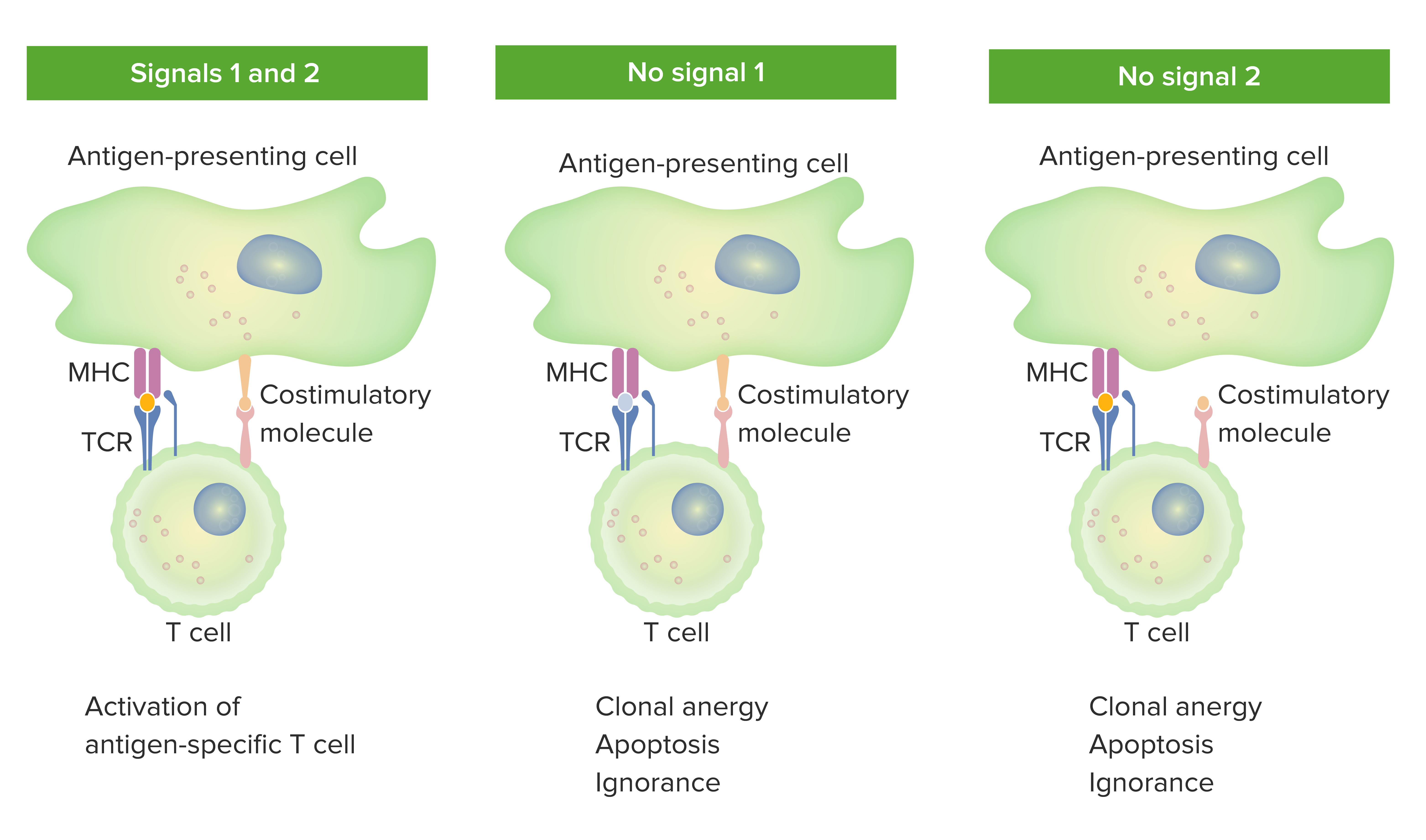
2-Signal-Modell der Abhängigkeit von T-Zellen von einer Costimulation:
Wenn sowohl Signal 1 (TCR-Antigen-Bindung an MHC-komplementärer antigenpräsentierenden Zelle) als auch Signal 2 (costimulatorische Interaktion von Oberflächenmolekülen antigenpräsentierender Zellen und der T-Zellen) vorhanden sind, wird eine reife T-Zelle vollständig aktiviert.
Der orangefarbene Punkt im linken Feld zeigt die passende Bindung zwischen Antigen und TCR. Wenn jedoch entweder Signal 1 (mittleres Bild: keine TCR-Antigen-Bindung) oder Signal 2 (rechtes Bild: fehlende Costimulation) fehlt, wird die T-Zelle nicht vollständig aktiviert.
Resultieren können Anergie (Zustand der Reaktionslosigkeit), Apoptose (Zelltod) oder Ignoranz (T-Zellen bemerken das Antigen nicht oder werden nicht davon beeinflusst).
TCR: T-Zell-Rezeptor
T-Helfer-Zellen haben werden von unterschiedlichen Zytokinen beeinflusst und schütten unterschiedliche Zytokine aus. Sie übernehmen so verschiedene Rollen bei der Immunantwort.
| CD4+ T-Zellen | Stimulierung der Differenzierung durch | Funktionen | Produzierte Zytokine |
|---|---|---|---|
| Th1 |
|
|
|
| Th2 |
|
|
|
| Th17 |
|
Förderung neutrophiler Entzündungen |
|
| Tfh | IL-6 | Ermöglicht B-Zell-Aktivierung und -Reifung |
|
| Treg |
|
|
|

Subtypen CD4-positiver T-Helferzellen:
Nach Aktivierung durch eine dendritische Zelle und Anwesenheit bestimmter Zytokine teilt sich eine naive CD4-positive T-Zelle und differenziert zu einem Effektor/Helfer- (Th1, Th2 oder Th17) oder follikulärem Helfer (Tfh)-Subtypen. Jeder Zelltyp produziert Zytokine, die die Aktivierung anderer Zellen des Immunsystems erleichtern.
IFN: Interferon
TNF: Tumornekrosefaktor

Mechanismen der Zytotoxizität von CD8+ T-Zellen: Links: Nach Kontakt mit einer infizierten Zelle setzt die T-Zelle zytotoxische Granula, Perforin und Granzyme frei. Perforin schafft eine Pore in der Membran der Zielzelle, durch die Granzyme in die Zelle eindringen können. Diese spalten Proteine innerhalb der Zelle, was schließlich zur Apoptose führt. Rechts: Wenn FasL mit Fas auf einer Zielzelle interagiert, wird die Caspase-Kaskade aktiviert und führt zur Apoptose.
FasL: Fas-Ligand TCR: T-Zell-Rezeptor
MHC: major histocompatibility complex
Bild von Lecturio
T-Gedächtnis-Zellen und exprimierte zelluläre Marker:
Die zentralen T-Gedächtnis-Zellen befinden sich in den lymphatischen Organen, während sich die peripheren T-Gedächtnis-Zellen in den peripheren Geweben befinden.